复旦大学周俭教授揭示肝癌转移新机制
复旦大学(附属中山医院)肝癌研究所周俭教授研究团队在2016年5月正式发表《Hepatology》(肝脏病学)杂志的文章"miR-28-5p-IL-34-Macrophage Feedback Loop Modulates Hepatocellular Carcinoma Metastasis"(IF=11.
19)。转移是恶性肿瘤最显著的生物学特征之一,也是肿瘤患者死亡的主要原因。肿瘤的侵袭转移是肿瘤细胞、宿主和肿瘤微环境之间一系列复杂的序贯连续过程。
microRNA(miRNA),通常含有22个碱基的短链非编码RNA,通过转录后水平调节功能基因的表达,发挥“癌基因”或“抑癌基因”的功能。周俭教授课题组通过实施一套完整缜密的研究流程,对参与肝癌转移的关键miRNAs进行筛选并对其功能展开系列研究。
首先,研究人员在具有不同转移潜能的人肝癌细胞株进行RNA-seq筛选,发现肝癌转移关键miRNA:miR-28-5p表达异常,且与细胞系转移潜能呈显著负相关;同时发现miR-28-5p只是体内具有促进肝癌转移的作用。
进一步,运用TargetScan生物信息学预测结合细胞因子/趋化因子PCR芯片进行筛选验证,发现miR-28-5p的重要靶基因白介素34 (Interleukin-34,IL-34)(请见图一)。
既往研究表明IL-34与单核细胞表面表达的集落刺激因子受体CSFIR结合,刺激巨噬细胞活化。本次研究发现,IL-34在体外激活FAK和ERK1/2信号通路,促进巨噬细胞增殖和趋化。
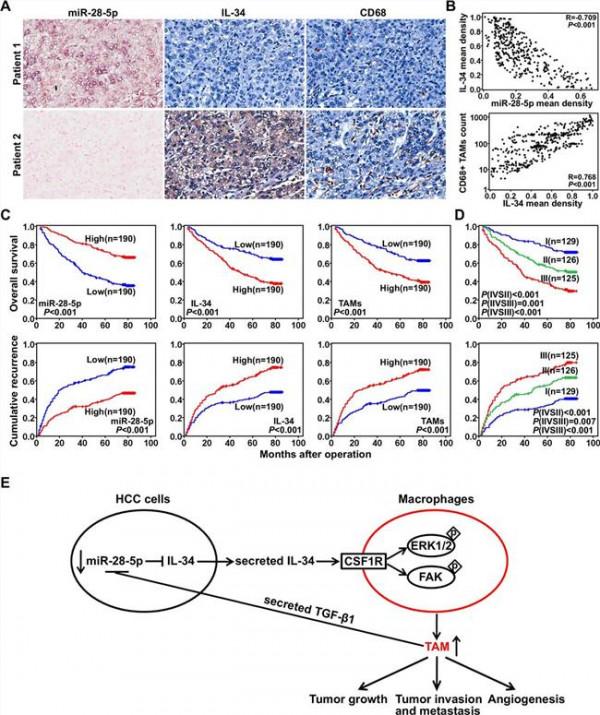
在动物实验中,肝癌细胞中IL-34的上调促进肿瘤细胞的生长以及肺转移,增加瘤内巨噬细胞浸润。值得注意的是,研究者发现巨噬细胞分泌细胞因子TGF-β1形成反馈回路参与miR-28-5p对IL-34的调控网络(请见图二)。
最后,肝癌样本中免疫组化分析表明,瘤组织中miR-28-5p 与IL-34表达水平显著负相关,与巨噬细胞的浸润、患者总生存期短以及肿瘤患者的复发显著相关。
多变量分析显示,miR-28-5p低表达/IL-34过表达或与瘤内巨噬细胞同时存在,都是一个独立的整体生存和癌症复发预后指标(请见图二)。该研究成果创造性地绘制出肝癌细胞中microRNA与肿瘤相关巨噬细胞(TAM)双向调控网络,揭示了肝癌转移调控新机制和潜在的分子靶点。
图一 白介素34 (Interleukin-34,IL-34)是 miR-28-5p的重要靶基因。实验采用上海吉凯公司提供的病毒载体。
图二 miR-28-5p与肿瘤相关巨噬细胞(TAM)双向调控网络。
作者简介:周少来博士,复旦大学附属中山医院肝肿瘤外科住院医师,主要从事肝癌炎症微环境调控肿瘤侵袭转移的机制研究,近五年以第一作者在Gastroenterology 、Hepatology等杂志正式发表SCI论著10篇,累积影响因子79.8,他引200余次。目前作为课题负责人主持国家自然科学基金青年基金和上海市扬帆计划课题各1项。