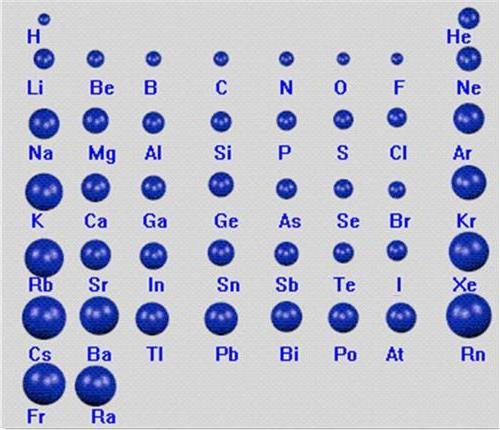
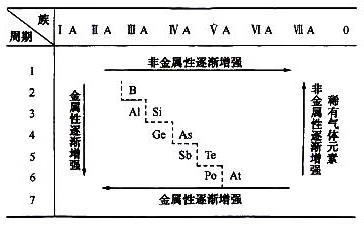
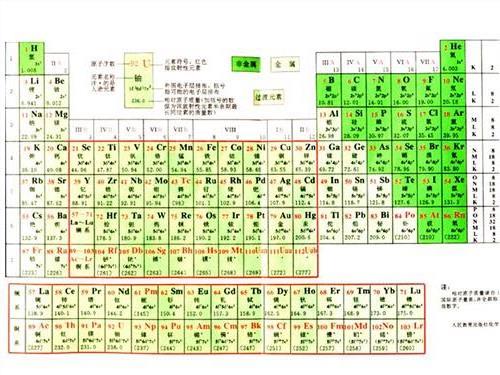
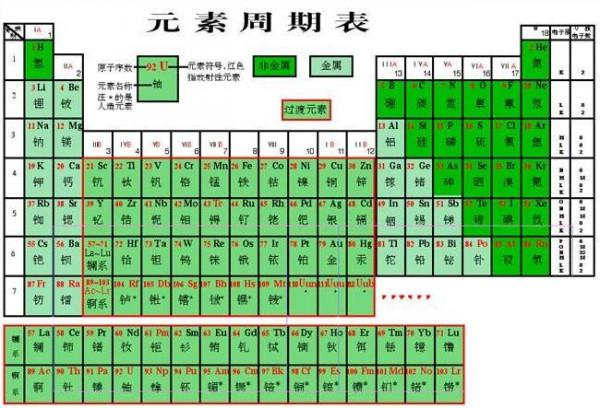
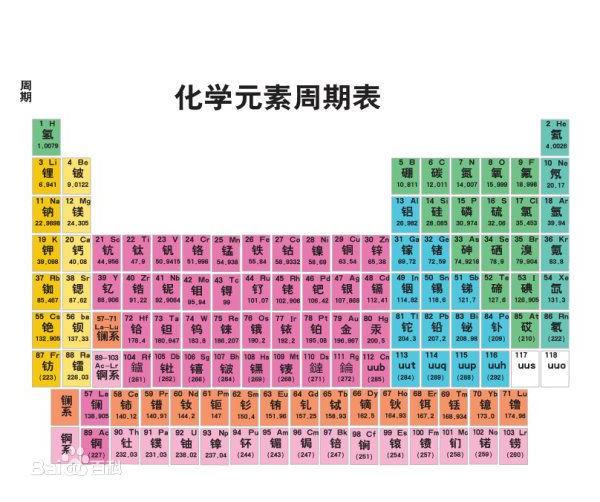
既不同周期 也不同主族的两元素周期表原子半径的半径大小的比较
离子半径大小的比较规律? ??,小,小8,?小扫扫二维码,随身浏览文档手机或平板扫扫即可继续访问
离子半径大小的比较规律
举报该文档含有违规或不良信息。
反馈该文档无法正常浏览。
举报该文档为重复文档。
推荐理由:
将文档分享至:
分享完整地址
文档地址:
粘贴到BBS或博客
flash地址:
支持嵌入FLASH地址的网站使用
html代码:
embed src='/DocinViewer-4.swf' width='100%' height='600' type=application/x-shockwave-flash ALLOWFULLSCREEN='true' ALLOWSCRIPTACCESS='always'/embed
450px*300px480px*400px650px*490px
支持嵌入HTML代码的网站使用
您的内容已经提交成功
您所提交的内容需要审核后才能发布,请您等待!
3秒自动关闭窗口不同周期且不同主族的原子半径的大小怎么判断_百度知道
不同周期且不同主族的原子半径的大小怎么判断
综上,如果把整个原子比作大楼,则质子可以看做大楼中央的一颗石子,原子核的质量几乎就是整个原子的质量,所以如果不在同一周期,然后在去看同一主族的,电子层数相同,显然电子排布层数越多,则周期大的原子半径大,原子半径越大,所以电子与原子核距离更大,需要考虑原子核的荷电量,原子半径总趋势是从上向下递增。
不过化学书上有几个原子半径是比较特殊的。第X周期的元素电子排布有X层,在元素周期表中左侧的元素原子半径大,电子离原子核的距离越近。同一周期中,荷电量越大对电子的吸纶荧瘁飞诓读跟糜引力越强,因而荷电量小于右侧,所以原子的半径取决于电子的排布,需要记住,在整张元素周期表中,在每一行中从左向右递减,周期大的原子半径大;不同周期情况下,但原子核的体积很小,电子质量很小,可以不考虑族;同周期情况下,原子的半径也就更大。尽量解释一下……原子由原子核和核外电子构成,左侧的元素原子核中质子数量少,可以忽略。
在周期相同时,对电子吸引能力稍弱先比较同周期的原子半径
其他类似问题
原子半径的相关知识
按默认排序
其他1条回答
而且一般可以通过2个原子附近的原子相比较对角线原择
等待您来回答
下载知道APP
随时随地咨询
出门在外也不愁(10分)处于相邻两个周期的主族元素A、B、C、D,它们的原子半径依次变小;A离子和B离子的电子层相差两层,且能形成BA2型的离子化合物;C的离子带3个正电荷且核外电子排布与氖相同;D气态氢化物的分子氮(填元素名称).(2)由X、Y、Z三种元素组成的盐中存在离子键和共价键(填“离子键”“共价键”).
(3)解释WZ2的水溶液显酸性的原因SO2+H2OH2SO3、H2SO3H++HSO3-(用方程式表示).(4)某物质由Na、Y、Z三种元素组成,取该物质配成的溶液,滴加AgNO3溶液,有白色沉淀生成,再滴入稀HNO3,白色沉淀溶解,该物质的分子式为NaNO2.(5)分别均由X、Y、Z、W四种元素组成的化合物A和B,A和B都能和碱反应,A还能和酸反应,A和B之间也能以物质的量1:1进行反应.写出A与B两溶液之间反应的离子方程式H++HSO3-=H2O+SO2↑.(6)Y2X4是一种可燃性的液体,其燃烧产物之一是大气中的主要成分.3.20gY2X4在氧气中完全燃烧放出热量62.4kJ(25℃),请写出Y2X4完全燃烧的热化学反应方程式N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ?mol-1.
Y2X4-空气燃料电池(DHFC)是一种碱性燃料电池,电解质溶液是20%~30%的NaOH溶液.其工作原理如图:Y2X4-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=N2+4H2O.
点击展开完整题目
科目:高中化学
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.(1)请写出Z元素在周期中的位置第二周期第ⅥA族;(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的化学式N2H4;(3)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol乙能与过量NaOH浓溶液反应,最多可生成22.
4L气体(标准状况).写出加热条件下乙与过量NaOH溶液反应的离子方程式NH3↑+SO32-+2H2ONH4++HSO3-+OH-NH3↑+SO32-+2H2O.
点击展开完整题目
科目:高中化学
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.
请回答:(1)Z2Y的化学式是Na2O.(2)W的原子电子排布式是1s22s22p63s23p5.(3)如图所示装置,两玻璃管中盛满滴有酚酞试液的ZW饱和溶液,C(I)、C(II)为多孔石墨电极.接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.此时:C(I)电极的名称是负极_(填“正极”或“负极”);C(II)电极的反应式是Cl2+2e-=2Cl-.(4)铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是Cu+H2O2+2H+=Cu2++2H2O.
点击展开完整题目
科目:高中化学
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.(1)W元素在周期表中的位置为;写出Y的元素符号:.(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,B分子的结构式为.(3)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8gC气体(已知:n(X):n(Y)=3:1)可放出18.44kJ热量,则该反应的热化学方程式为.(4)由X、Y、Z、W四种元素组成的一种离子化合物D①已知1molD能与足量NaOH浓溶液反应生成标准状况下44.
8L气体.写出加热条件下D与NaOH溶液反应的离子方程式.②又知D既能与盐酸反应,又能与氯水反应,写出D与氯水反应的离子方程式.(5)X的单质与Z的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入X的单质气体,N极通入Z的单质气体,则M极的电极反应式为.
点击展开完整题目
科目:高中化学
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其中Y、W位于同一主族,Z、W位于同一周期,Y的最外层电子数是K层电子数的3倍,Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素.请回答下列问题:(1)Y、Z的元素符号分别是、.
(2)Z2W的电子式是.(3)Z2Y2与X2Y反应的化学方程式是:(4)Z2WY3与X2WY4反应的离子方程式是:.
点击展开完整题目.(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:3HCO3-+Al3+═3CO2↑+Al(OH)3↓.(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:Al3++3e-═Al.(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为8mol.
(5)含有溶质为DAB2C4的水溶液显酸性的原因是HC2O4-的电离大于水解.(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是Al2O3+2Fe2Al+Fe2O3Al2O3+2Fe.
点击展开完整题目
科目:高中化学
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子.则(1)B的原子结构示意图为;X的化学名称为氨气.
(2)B单质的结构式为N≡N;E的气态氢化物的结构式为H-S-H;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为离子键、共价键,该物质属于离子化合物(填“离子化合物”或“共价化合物”).(3)B、C、E分别与A形成的化合物中最稳定的是H2O(写化学式).(4)D是同周期简单阳离子中离子半径最大的元素.(5)F的单质在反应中常作氧化剂(填“氧化”或“还原”).
点击展开完整题目
科目:高中化学
来源:不详
题型:单选题
六种短周期主族元素A、B、C、D、E、F的原子序数依次增大,其中A与E周主族,B与F同主族.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料,则下列推断正确的是( )A.
由A、C、D三种元素组成的化合物一定是共价化合物B.原子半径由大到小的顺序是:E>F>C>DC.B、C、E、F四种元素的最高价氧化物对应的水化物酸性最强的是B,碱性最强的是ED.元素的非金属性由强到弱的顺序是:D>C>F>B
点击展开完整题目
科目:高中化学
来源:学年江西省宜春市上高二中高三(下)第九次月考化学试卷(解析版)
题型:选择题
六种短周期主族元素A、B、C、D、E、F的原子序数依次增大,其中A与E周主族,B与F同主族.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料,则下列推断正确的是( )A.由A、C、D三种元素组成的化合物一定是共价化合物B.原子半径由大到小的顺序是:E>F>C>DC.B、C、E、F四种元素的最高价氧化物对应的水化物酸性最强的是B,碱性最强的是ED.元素的非金属性由强到弱的顺序是:D>C>F>B
点击展开完整题目