元素周期律、元素周期表学法指导
元素周期律和元素周期表是化学理论的重要组成部分,学好本部分知识对元素化合物知识的学习起着非常重要的作用。现将本部分的学习指导总结如下:
(1)金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子失去电子的能力→元素的金属性→最高价氧化物对应水化物的碱性→单质置换水(或酸)中氢的能力→单质的还原性→离子的氧化性。
(2)非金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子获得电子的能力→元素的非金属性→最高价氧化物对应水化物的酸性→气态氢化物形成难易及稳定性→单质的氧化性→离子的还原性。
2、理解判断元素金属性或非金属性强弱的实验依据
单质与水(或酸)反应置换氢越容易,元素的金属性越强。最高价氧化物对应的水化物的碱性越强,元素的金属性越强。相互间的置换反应,金属性强的置换弱的。原电池中用作负极材料的金属性比用作正极材料的金属性强。
与氢气化合越容易(条件简单、现象明显),气态氢化物越稳定,元素非金属性越强。最高价氧化物对应的水化物的酸性越强,元素的非金属性越强。相互间置换反应,非金属性强的置换弱的。
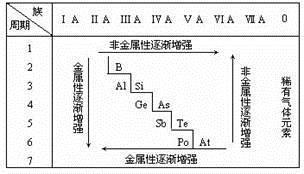
1、同周期元素“四增四减”规律
同周期元素从左至右:原子最外层电子数逐渐增多,原子半径逐渐减小;非金属性逐渐增强,金属性逐渐减弱;最高价氧化物对应的水化物的酸性逐渐增强,碱性逐渐减弱;非金属气态氢化物的稳定性逐渐增强,还原性逐渐减弱。
2、同主族元素“四增四减四相同”规律
同主族元素从上到下:电子层数逐渐增多,核对外层电子的引力逐渐减弱;金属性逐渐增强,非金属性逐渐减弱;非金属气态氢化物的还原性逐渐增强,稳定性减弱;最高价氧化物对应的水化物的碱性逐渐增强,酸性逐渐减弱。
四相同:原子最外层电子数相同;最高正化合价、最低负化合价相同;最高价氧化物及其水化物通式相同;非金属气态氢化物通式相同。
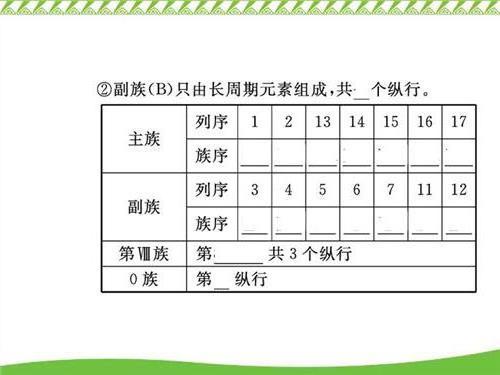
具有相同电子层结构的阴、阳离子,阴离子必位于与之有相同电子层结构的稀有气体元素的前面(与该稀有气体元素同周期),而阳离子位于该稀有气体元素的后一周期,再通过阴、阳离子所带电荷数即可确定其所处主族数。
元素的原子序数为奇(或偶)数,则其在周期表中所处主族序数及最高正化合价数必为奇(或偶)数。若结合数学中“两奇数(或两偶数)的和或差必为偶数,奇数与偶数的和或差必为奇数”的规律,会给解题带来方便。