南通大学附属医院26患者被注射问题气体 2人已失明(图)
4月8日消息,据江苏新闻广播报道,南通26名眼病患者反映,他们在南通大学附属医院注射了一种名为全氟丙烷的气体,用来治疗视网膜脱落等病症,可谁知该批次医用气体属于问题医疗器械,后被国家食药监总局召回。现在,部分患者眼球严重受损甚至失明。
针对此事件,今天下午,南通市食品药品监督管理局微信发布《关于“眼用全氟丙烷气体”不良反应的情况通报》。
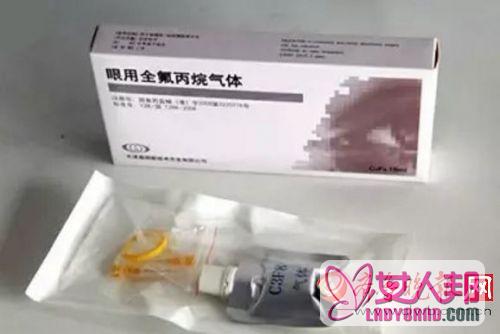
全氟丙烷气体是一种用于眼部手术的填充气体材料,临床主要用于玻璃体视网膜手术,使脱离的视网膜复位、愈合,是一种常见的眼科手术材料。
22人眼睛已经失明
据媒体报道,患者们介绍,26名患者中,他们相互之间能够联系上的有20个人,都注射了问题批次的产品,最小的30岁,最大的67岁,分别来自江苏南通、扬州、苏州、盐城和湖北。
江苏新闻广播记者已联系上26名患者中的7个人,其中2人被注射问题气体的眼睛已经失明、无光感,2人接近失明、仅有光感,另外3人也出现了严重的视力衰退。
其中,2015年6月14号,六十七岁的刘兰英因为右眼视网膜脱离在通大附院进行了眼部手术,并注射了全氟丙烷气体保持眼压。可术后有严重的炎症。目前刘女士的视神经萎缩,右眼已经失明。
据了解,26位患者使用的眼部气体生产厂家为天津晶明新技术开发有限公司。
2015年7月8号,国家食品药品监管总局办公厅曾向全国发出《关于暂停销售使用天津晶明新技术开发有限公司生产的眼用全氟丙烷气体的通知》,要求立即暂停销售和使用该公司生产的批号为15040001的眼用全氟丙烷气体。
2
12015年7月9日,国家卫计委也发出了相关通知,要求停止使用部分眼用全氟丙烷气体。
1院方已将厂家告上法庭
南通大学附属医院门诊部研究员仇永贵表示,产品由院方直接向天津晶明新技术开发有限公司购买,厂家的资质及产品合格证书符合规定。院方认为自身没有专业能力检测该气体产品的好坏。
目前,院方已经将天津晶明新技术开发有限公司告上法庭,法院已经冻结了该公司的资金账户,患者的后续赔偿费用问题将会得到保障。
4月8日傍晚时分,通大附院发布关于使用天津晶明新技术开发有限公司生产的眼用全氟丙烷气体引起不良反应的情况通报,全文如下:
我院使用天津晶明新技术开发有限公司生产的眼用全氟丙烷气体引起群体性不良事件的有关情况,现向关心患者、爱护医院、寻求真相的广大公众通报如下:
一、使用情况
我院于2002年开始使用天津晶明新技术开发有限公司生产的眼用气体,一直没有发生不良反应。
2015年6月,我院按惯例向该公司购买了生产规格为15ml的眼用全氟丙烷气体(简称C3F8)40支(医疗器械注册证号:国食药监械(准)字2014第3221571号;产品批号:15040001),总计人民币5200.00元。
该产品于2014年9月5日经国家食品药品监督管理总局审查符合医疗器械产品市场准入规定,准许注册,主要适用于玻璃体切割、视网膜脱离等眼科手术。
二、发现经过
我院眼科在2015年6月底陆续发现一些实施眼底手术的患者出现眼内不同程度的不良反应,表现为眼内纤维素性渗出、晶状体混浊、视神经萎缩、视网膜血管阻塞等。
医院组织多部门对这些患者进行调查,排除了手术、医院感染等其它因素情况下,发现这些患者均使用了全氟丙烷气体,出现不良反应的为2015年6月5日至6月29日期间的26名患者。
而我院2015年6月5日以前使用的该公司之前批次的全氟丙烷气体患者没有出现不良反应,经全面调查发现与使用该批次产品相关,最终将眼部不良反应的原因锁定在该批次的眼用全氟丙烷气体。
三、处置情况
医院高度重视,立即成立“全氟丙烷气体”事件处置领导小组,多次召开会议,以全力救治患者为第一要务,邀请了国内、省内眼科权威专家来院会诊。
在患者未向我院提出投诉的情况下,我院主动与所有使用该批次的患者进行了联系,通知来院复查。根据专家意见对其中的23名患者分批分次连夜进行了补救手术,清除残余问题气体,填充硅油等,并持续进行密切随访和治疗。
2015年7月3日、4日,医院向国家、省、市的卫生行政部门、食品药品监督部门、药品不良反应监测中心做了汇报。同时医院内部进行调查,排除了手术、医院感染等医源性因素。国家食品药品监督管理局也派专家组来院调查,认可医院对患者的后续处置与原因分析。
2015年7月9日,国家食品药品监督管理局发出特急文件,要求在全国暂停销售使用该批次眼用全氟丙烷气体并对已发出的产品进行召回。经中国食品药品检定研究所检验,医院于9月1日收到出具日期为2015年7月27日的《检验报告》,结论为:按YZB/国4936—2014《眼用全氟丙烷气体》、GB/T 16886.10—2005检验,晶明公司生产的批号为15040001的眼用全氟丙烷气体的含量、皮内反应不符合规定,检定结果为不合格。
2015年12月3日,我院收到《国家卫生计生委医政医管局关于眼用全氟丙烷气体群体不良事件处理协调会的函》,12月7日,我院与北京大学第三附属医院、北京市卫生计生委、天津市卫生计生委、江苏省卫生计生委抵京参会,会上国家卫生计生委对我院前期的救治和处置工作表示肯定。
四、院方态度
医院虽然也是受害者,但以患者权益为重,不回避矛盾。在发生眼科患者术后眼内急性炎症反应后,医院及时排查原因,找到可疑气体,及时上报,引起国家相关行政部门的高度重视。国家相关行政部门经过调查,发文在全国暂停使用疑似气体,避免了其他医院更多患者受到类似伤害。
我院对于患者遭遇的不幸深感痛心,积极补救和追踪病人复查。
在此事件中,经治医生内心压力巨大,部分高年资主任医师觉得无颜面对患者和家属,向医院提出了辞职申请。医院对他们进行心理辅导、积极化解。
目前,已有一名患者向南通市崇川区人民法院提起诉讼,我院也向法院对天津晶明新技术开发有限公司提起诉讼,法院已经冻结了该公司的资金帐户及实施财产保全。医院将本着“以人为本”的原则,与患者一起依法维权,最大程度上维护患者的合法权益。
我们期待着法院的依法裁判。
南通大学附属医院
2016年4月8日
南通市食品药品监管局下午发布情况通报
4月8日下午,南通市食品药品监管局微信发布《关于“眼用全氟丙烷气体”不良反应的情况通报》,全文如下:
情况通报
2015年7月4日晚,南通市食品药品监管局(以下简称我局)接到南通大学附属医院7份不良事件报告,均涉及同一产品“眼用全氟丙烷气体”(标示生产厂家:天津晶明新技术开发有限公司,注册账号:国食药监械(准)字2014第3221571号,产品标准:YZB/国 4936-2014《眼用全氟丙烷气体》,批号:15040001,规格:15ml),在使用后病人发生葡萄膜炎反应,可能导致机体功能结构永久性损伤,院方已停止使用该产品并组织开展相应救治。
接到报告后,我局当即研究处置工作并对全市产品使用情况紧急调查,同步向江苏省药品不良反应监测中心报告。次日,我局组成调查组赴医院开展现场调查,对产品生产企业资质、产品批文、购进手续、产品出厂检验报告、出入库手续、业务员的授权书等材料等进行了全面调查,对该批次产品库存全部抽样控制,派专人送中国食品药品检定研究院检测。
6日,我局向全市发出《关于暂停使用天津晶明新技术开发有限公司生产的“眼用全氟丙烷气体”的紧急通知》,要求立即暂停使用天津晶明新技术开发有限公司生产的“眼用全氟丙烷气体”产品。后国家总局向全国发出《关于暂停销售使用天津晶明新技术开发有限公司生产的眼用全氟丙烷气体的通知》,要求立即停用该批产品。
7月9日,国家及我省ADR中心赴通大附院开展现场核查,对我局及通大附院ADR处置工作给予了肯定。
8月31日,我局收到省局转交中国食品药品检定研究院出具的关于该批次产品的《检验报告》,报告显示该批次产品的含量、皮内反应两个检验项目不符合国标规定。
9月1日,我局到通大附院送达检验报告并立案调查,对院方提供的生产厂家、产品的资质材料、出厂检验报告书、出入库单、业务员的授权书等材料进行了证据固定。
由于该起医疗纠纷未处置终结,我局将密切关注事态进展,相关案件信息将在第一时间通报。
南通市食品药品监督管理局
2016年4月8日