张奇伟北师大 Nat Met:清华大学医学院张奇伟课题组及合作者为超分辨显微技术引入新维度
近日,国际学术权威刊物自然出版集团旗下子刊《Nature Methods》杂志在线发表了清华大学医学院张奇伟教授课题组及北京大学席鹏教授、澳大利亚悉尼技术大学金大勇教授合作的一篇研究论文,论文报道了一种新的基于偏振反解调的超分辨偶极子取向解析技术(Super-Resolution Dipole Orientation Mapping via Polarization Demodulation),不仅为超分辨提供了一种全新的维度。
清华大学自动化系博士生陈龙和北京大学工学院博士生张昊是共同第一作者,清华大学张奇伟课题组高军涛副研究员、北京大学席鹏教授、澳大利亚悉尼技术大学金大勇教授为共同通讯作者。
荧光的偏振特性(Fluorescence Polarization)早在1926年就被发现。在超分辨成像中,荧光的其他特性如强度、光谱、荧光寿命等均有很好的应用,然而对于荧光偶极子的方向(偏振)则很少关注。
在2014年,德国马普所Walla课题组在Nature Methods上发表文章,通过对激光进行偏振调制来实现稀疏重构的超分辨成像[3]。而在本年年初,德国科学家Keller等人则对此提出了质疑,在Nature Methods期刊发表了针对这一文章的评论:利用荧光偏振不能够获得进一步的超分辨。
Walla课题组立即进行反驳,从宽场的角度论证,偏振调制带来的周期性变化的信号差异,可以区分衍射极限水平下无法分开的点,说明偏振对超分辨的获取确实有用[5]。
然而偏振调制对超分辨能力的提升是否有效以及如何提供更多信息,依然没有定论,因为以上双方(Walla课题组和Keller课题组)都是从传统的荧光强度来看待这一问题。
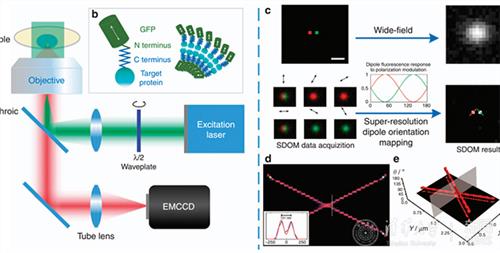
清华大学张奇伟教授课题组及其合作者研究发现,荧光偏振性是否对超分辨成像有提升,关键在于能否解析出超分辨偶极子取向信息,因此从荧光强度和荧光各向异性来考虑,解析出超分辨荧光偶极子取向,并提出了一种叫SDOM(Super-resolution Dipole Orientation Mapping,图1)的新的超分辨技术,从而完美地回答了这一争论[6]。
偶极子受到偏振激发释放出余弦周期信号,在显微成像过程受到衍射作用和相机采样误差的影响。
事实上,光学显微成像是一个以点扩散函数为核的卷积和泊松采样的过程,进一步考虑短时间内恒定噪声的因素,张奇伟教授课题组及其合作者完成了成像的统计建模。
基于相机采集的光子数信息,估计荧光分子的位置和强度。课题组采取贝叶斯估计的思路,利用极大后验将图像重构过程转化为稀疏约束的凸优化问题。快速迭代收敛阈值算法实现了优化模型求解[7],使得偏振调制信号得到恢复。对恢复信号进行三角函数拟合提取出超衍射极限的偶极子取向,最终在实现强度超分辨重建的基础上实现角度超分辨信息的解析,拓宽了超分辨成像的认知视角。
传统的荧光各向异性显微成像技术往往只能够观察简单样本的荧光偏振。对于复杂样本,荧光的偏振由于阿贝衍射极限的存在会受到众多荧光团的影响,从而只能观察到平均效果。SDOM技术不仅提升了成像的空间分辨率,也提升了探测荧光团偶极子方向的精度。
同时,SDOM技术具有很快的成像速度(最快可达每秒5帧超分辨),对激发光功率要求很低(毫瓦量级),非常适用于活细胞观察。偶极子取向的超分辨解析,使得通过强度无法看到的结构细节能够被角度信息反映出来。
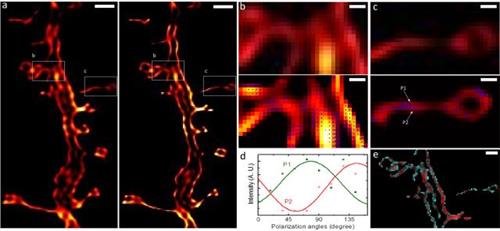
课题组对Walla文章中的海马神经元图像重新进行了分析,经SDOM重建后(图2 c下)发现偶极子取向的异质性分布,揭示了树突棘的不同膜边界结构,而这在Walla的工作中,是无法得到这一信息的(图2c上)。
为了进一步展示该方法的有效性,研究者把该技术首先应用在哺乳动物细胞的actin蛋白成像中,超分辨偶极子取向信息提供了更多的结构细节。之后,作者将该技术应用于活体酵母细胞中的septin蛋白成像观测,同样得到了更加精细的结构信息。
由于基因组三维结构目前在世界上掀起一轮新的研究热潮,同时也是张奇伟课题组的重点研究方向,而NPC(核孔复合体)对于染色体在细胞核内的定位及基因组的三维结构非常重要,所以,研究者也利用该技术对NPC进行了SDOM成像,得到了核孔的第一张偏振超分辨图像。总之,SDOM对超分辨水平下偶极子取向的解析非常有效,对活细胞结构动力学的研究有着极大应用价值。
图 1: SDOM的原理示意图。SDOM不仅带来了分辨率的提升,且能够为超分辨提供一个全新的荧光偶极子的维度,能够更清晰地认识其标记的蛋白结构。
图2: Walla的SPoD超分辨成像(a图左)和SDOM成像解析(a图右)的对比