施一公知乎 施一公取得突破 什么突破如此受关注
那么,究竟是什么样的科研成果会有望获诺贝尔奖?在学术生涯不断走向巅峰时“走向仕途”能两边都兼顾好吗?
破解结构生物学最大难题之一
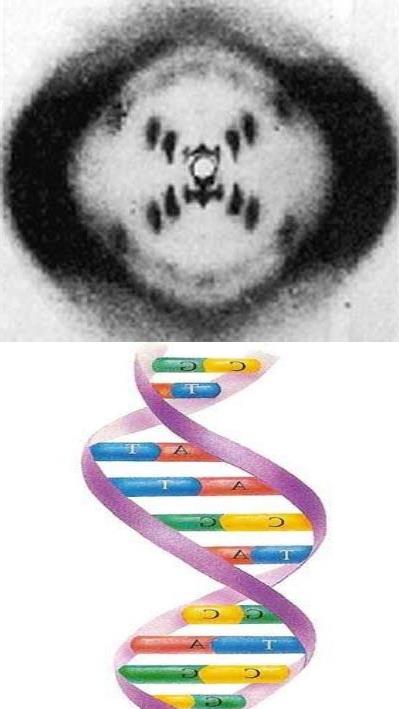
8月21日,清华大学生命科学学院施一公教授研究组在《科学》周刊(Science)同时在线发表了两篇背靠背研究长文。研究组不仅获得了分辨率高达3.6埃的剪接体三维结构,并阐述了剪接体的基本工作机理,破解了结构生物学最大难题之一。
在真核生物中,基因表达分别由RNA聚合酶、剪接体和核糖体执行。其中,RNA聚合酶和核糖体的结构解析曾分别获得2006年和2009年的诺贝尔化学奖。而剪接体是生命中的一种大生物“机器”,能帮助DNA转化为蛋白质。其结构解析的难度被普遍认为高于RNA聚合酶和核糖体。
6月24日,剑桥大学分子生物学实验室的日裔学者Kiyoshi Nagai研究组在线发表在《自然》杂志上的一项研究将剪接体所涉及的一个中心复合物tri-snRNP的分辨率提高到了5.9个埃米,一度引起轰动。而此前人类对基因剪接体的认识精度只有29个埃米。
而施一公团队此次得到的结果不仅将精度由5.9个埃米提高到了3.6个埃米,而且其解析对象是真正的剪接体,而不是Nagai团队所取得的参与剪接体组装过程的复合物,从而第一次在近原子分辨率上看到了剪接体的细节。
诺奖得主等“大牛”如何评价?
施一公研究组的文章一经发布,不仅轰动了国内生物圈,也引起了很多国际顶尖科学家的关注。包括2009年诺贝尔生理与医学奖得主、哈佛大学医学院教授Phillip Allen Sharp在内的科学家纷纷对这项研究给予了很高的评价。
因发现RNA剪接而获得1993年诺贝尔生理学与医学奖,2006年美国国家科学奖章获得者,美国MIT生物系教授
施一公教授在《科学》杂志发表的两篇文章里展示的剪接体及其反应活性中心的结构非常振奋人心,这是RNA剪接领域的突破。我之前不确定我们是否真的能“看到”在活性状态下的剪接体结构,因为构成它的蛋白和RNA是如此多样并复杂。在这两篇文章里,我们看到了冷冻电镜的技术、攻克难题的决心、以及创造性的想法,这三点对此次的成功缺一不可。再次祝贺取得此次巨大的成果。
2009年诺贝尔生理与医学奖得主,哈佛大学医学院教授
施一公教授实验室近期在《科学》杂志上发表的两篇论文为理解剪接体的结构和工作机制带来了巨大的突破。剪接体是细胞内最后一个被等待解析结构的超大复合体,而这一等待实在已经太久了。
相较于核糖体,在原子分辨率解析剪接体的结构更为困难,因为剪接体由一系列不同蛋白质和蛋白核酸复合物组成,组分和构象都是高度复杂和动态的。施一公实验室利用最新的冷冻电镜技术克服了种种困难(解析了结构),这一成果为理解这个超级复杂的大分子机器的工作机理呈现出全新的画面。比如,人们可以清楚地看到剪接体的结构和IIb类自剪接内含子结构之间的密切关系;人们也可以看到许多剪接体的关键蛋白成分的作用。
美国斯隆-凯特琳癌症研究中心教授,美国科学院院士、美国科学与人文学院院士、著名结构生物学家、核酸研究领域专家
剪接体结构的解析比核糖体结构的解析的更加具有挑战(2009年有三位科学家因解析核糖体结构被授予诺贝尔奖)。剪接体结构解析的复杂性主要反映在它形态多变、成分复杂,比如剪接反应的不同阶段不同RNA和蛋白质会进入或离开剪接体的核心区域。
剪接体的结构是完完全全由中国科学家利用最先进的技术在中国本土完成。这是中国生命科学发展的一个里程碑,它将影响并鼓励下一代青年人进入生命科学研究领域,勇往直前攻克最具挑战性以及最具影响力的生命科学难题。施一公教授实验室向这个生命科学领域中几乎不可能完成的挑战发起挑战,并在世界舞台上取得了成功。这些成就也很好地反映了中国科学领导者及科研资金支持等部门独具慧眼,选择正确的科学家对其重要的课题大力支持。