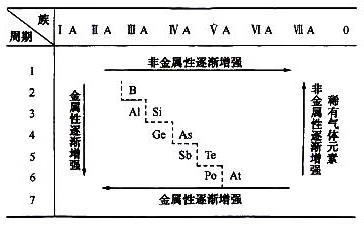
在元素周期表中同一周期 同一主族 元素性质的一般变化规律是
元素周期表中同一周期元素的特点问题补充:还有同一族元素的特点2012-2-18
【推荐答案】
我是高中化学老师,你应该是高一学生吧。
同一周期元素电子层数一样,从左到右最外层电子数逐渐增加,原子半径逐渐减少。
同一主族(高中不要求掌握副族)元素最外层电子数相等,化学性质相似,从上到下电子层数逐渐增加,原子半径逐渐增大。
典型的是碱金属元素和卤族元素。一定要弄清楚他们金属性或者非金属性发生递变的原因。记得“结构决定性质,性质反应结构”。
我刚刚给学生上完必修二第一节。有什么不懂得随时再问。
2012-2-18荐
元素周期表:特点
元素周期表:知识【其他答案】
同一周期元素电子层数相同,从左到右最外层电子数逐渐增加,原子核对核外电子束缚能力增强,原子半径逐渐减少,还原性减弱,氧化性增强;
以第三周期为例记忆
同一主族元素最外层电子数相等,化学性质相似,从上到下电子层数逐渐增加,原子半径逐渐增大。还原性增强,氧化性减弱,
以第一主族碱金属元素和第七主族卤族元素为例。一定要弄清楚他们金属性或者非金属性发生递变的原因。记得“结构决定性质,性质反应结构”。第一主族碱金属元素从上往下r增大失电子能力增强,还原性增强第七主族卤族元素从上往下r增大得电子能力减弱,氧化性减弱
2012-2-28
同一周期元素电子层数都是一样的,从左到右最外层电子数逐渐增加,原子半径逐渐减少(不含稀有气体)
从左到右非金属性增强,还原性减弱,氧化性增强,从右到左金属性增强,还原性增强,氧化性减弱
同一主族元素最外层电子数相等,化学性质相似,从上到下电子层数逐渐增加,原子半径逐渐增大(不包括稀有气体)
从上到下金属性增强,从下到上非金属性增强
2012-3-3
高中化学里的元素周期表中,有关同一主族的元素的熔沸点的问题!!!~~谁知道为什么同一主族的元素:金属元素比如第一主族越往下原子半径越大,熔沸点越低,但到了卤族元素,就是从上往下越来越高?
能详细讲一下原因吗?那样就容易理解了!谢谢咯!~~
好的回答有追加分哦!````
2006-9-8
【最佳答案】
物质的熔沸点是由物质的结构决定决定的.譬如金属是金属晶体、一般非金属单质是分子晶体和原子晶体、还有一些离子晶体。一般来讲这几种晶体的熔沸点由高至低的书顺序是:原子晶体、离子晶体、金属晶体、分子晶体。但这一顺序也不一定全部都对。譬如金属钨的熔点高达3000多度,这高于一般的离子晶体。
具体问题具体分析。
金属晶体的熔沸点取决与金属中金属键的强度,而金属键的强度主要与原子半径、最外层电子数有关。原子半径越大,原子核对最外层的电子的束缚性越弱,则金属键的强度越弱,金属的熔沸点越低。第一主族就是这种情况,而副族金属的电子层排部不如主族排部有序,目前有人认为副族金属晶体中还存在一部分共价键这使得有一部分金属的熔沸点较高。
而卤族元素属于分子晶体。分子晶体的熔沸点由分子间的范德化力的大小决定,而范德化力跟分子量有关,一般分子量越大,范德化力越大(这有点类似万有引力,因为分子晶体的分子距离差别不大)、熔沸点越高。
2006-9-8荐
元素周期表:熔沸点
高中化学里的元素周期表中同一主族的元素的熔沸点递增还是递减是怎么判断的啊?谁能详细解释一下方法啊?谢谢拉!!!!!!!!!
2006-9-8
【最佳答案】
通常来说,金属元素比如第一主族,越往下原子半径越大,熔沸点越低,到了卤族元素,就是从上往下越来越高。在分子晶体里,一般遵循着“结构类似的物质,相对分子质量越大其熔沸点越高”。
2006-9-8荐
元素周期表:熔沸点
元素周期表中有无元素的物理性质(熔沸点)变化规侓?如有,讲一下,并说明原因!拜托了!! 2007-4-14【最佳答案】
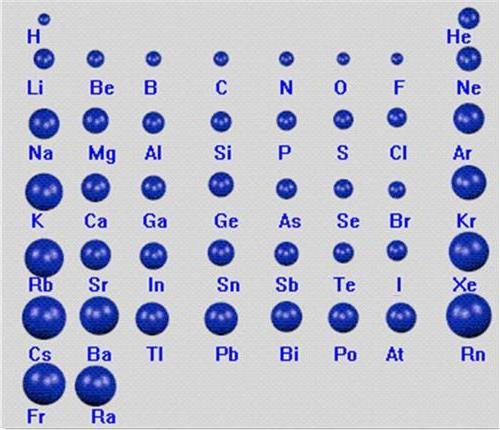
1元素周期表中元素及其化合物的递变性规律1.1原子半径
(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大。1.2元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的最高正价、负价均相同1.3单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增1.
4元素的金属性与非金属性
(1)同一周期的元素从左到右金属性递减,非金属性递增;
(2)同一主族元素从上到下金属性递增,非金属性递减。1.5最高价氧化物和水化物的酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。1.6非金属气态氢化物
元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
1.7单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
2.推断元素位置的规律
判断元素在周期表中位置应牢记的规律:
(1)元素周期数等于核外电子层数;
(2)主族元素的序数等于最外层电子数;
(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
参考资料:
2007-4-19荐
元素周期表:性质
元素周期表:读音【其他答案】
物理性质不象化学性质那样有递变规律不过在有的族元素的物理性质也是有递变规律的
如第一主族
由锂--铯
容沸点降低又如
F2----I2
容沸点依次身高。。。。但是并不是所有的都是有递变规律的
就象课本上所举到的“氢键”
2007-4-14
元素周期表中主族与副族有何区别?越详细越好。
回答得好追加分。
2008-2-12
【最佳答案】
对照元素周期表,其中A代表主族,B代表副族。
每个族里的元素在化学性质和物理性质上有相似性和递变性,这个在高中化学里到学到。
VIII族实际上是由三列组成的,均属于副族元素,但由于是三列,与其它组不同,故不加AB。主族元素无论是周期还是主族之间都会有规律可寻,然而副族元素通常是比较另类,或者是多种平行元素遵循一个规律。所以为副族主族:由短周期元素和长周期元素共同构成的族叫做主族。表示方法为:第一主族(ⅠA)、第二主族(ⅡA)等等。
主族序数=最外层电子数=最高正价=8-
副族:完全由长周期元素构成的族叫做副族,表示方法为:第一副族(ⅠB)、第二主族(ⅡB)等等。主族元素电子排布有规律,比如最外层电子依次增多。而副族元素电子排布无规律,最外层一般有一个电子,最多有三个
2008-2-12荐
元素周期表:规律
元素周期表:同位素【其他答案】
主族:
由短周期元素和长周期元素共同构成的族。周期表纵行中共有七个主族,分别用ⅰA、ⅱA……表示。从ⅰa到ⅶa依次称碱金属、碱土金属、硼族、碳族、氮族、氧族和卤族。同一主族元素化学性质相似,而从上到下元素的金属性逐渐增强,非金属性逐渐减弱。副族:
完全由长周期元素构成的族。周期表纵行中共有七个副族,分别用ⅰb、ⅱb……表示。从ⅰb到ⅶb依次称铜族、锌族、钪族、钛族、钒族、铬族和锰族。副族元素都是金属元素。
2008-2-12