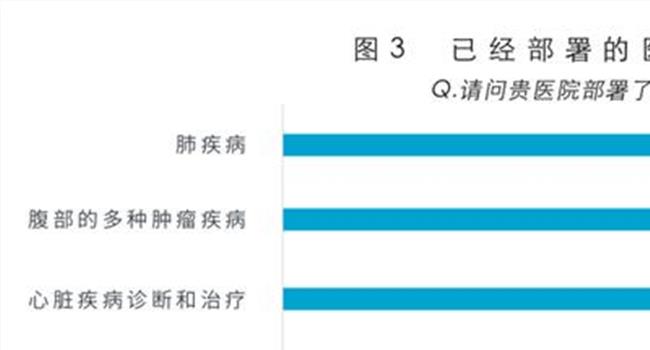
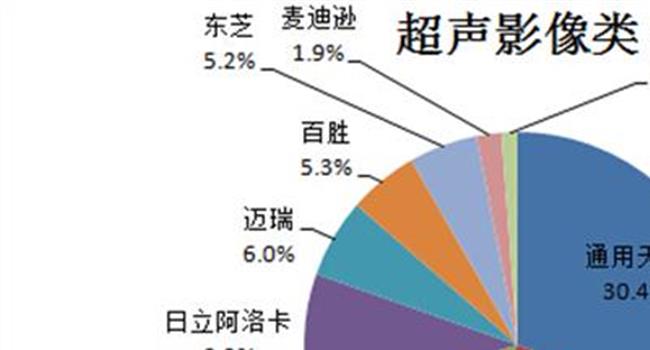
【医疗器械分类目录2019】医疗器械拓展性临床试验管理规定征求意见
8月28日,国家药品监管局就《医疗器械拓展性临床试验管理规定(征求意见稿)》(以下简称《征求意见稿》)公开征求意见。《征求意见稿》共六章31条,对医疗器械拓展性临床试验的权益和责任、启动条件、过程管理、数据收集等进行了明确规定。
根据《征求意见稿》,医疗器械拓展性临床试验是指患有危及生命且尚无有效治疗手段的疾病的患者,可在开展临床试验的机构内使用尚未批准上市的医疗器械的活动和过程。
拓展性临床试验医疗器械的使用需基于已有临床试验观察可能使受试者获益,且患者由于临床试验机构已按临床试验方案完成病例的入选,不能通过参加已开展的临床试验获得该医疗器械的使用。
按照《征求意见稿》,受试者参加医疗器械拓展性临床试验应当是自愿的,需要签署知情同意书。知情同意应当确保受试者了解其将接受试验用医疗器械的治疗,被明确告知受试者拓展性临床试验所用医疗器械尚未获得境内上市许可,以及试验用医疗器械在安全性和有效性方面可能存在的风险。在试验过程中,受试者有权随时退出。
《征求意见稿》要求,开展医疗器械拓展性临床试验的受试者、研究者、申办者和临床试验机构应当签订协议,明确各方权利、义务和责任。申办者、研究者、临床试验机构和伦理委员会应当参照《医疗器械临床试验质量管理规范》承担各自的责任。
《征求意见稿》强调,当医疗器械拓展性临床试验过程中有“出现与试验医疗器械可能有关的严重不良事件”“试验过程中发现试验用医疗器械可能存在严重质量缺陷”“应当暂停或者终止医疗器械拓展性临床试验的其他情形”三种情形之一的,研究者、申办者应当暂停或者终止医疗器械拓展性临床试验,并及时报告临床试验机构医疗器械临床试验管理部门。被暂停的医疗器械拓展性临床试验,未经伦理委员会同意,不得恢复。
在数据方面,《征求意见稿》要求,医疗器械拓展性临床试验数据的分析评价主要关注安全性数据,在此基础上可兼顾有效性数据,以对拟注册产品进行全面评价。